日々の診療の中で次々と出現する疑問を解決し、新たな治療法を開発するため、当不整脈グループは、臨床研究にも心血を注いでおります。特に、心房細動という不整脈に関しては、その原因や治療方法にはまだまだ未解明な点が多く、当グループは複数の先駆的な臨床研究を進めております。
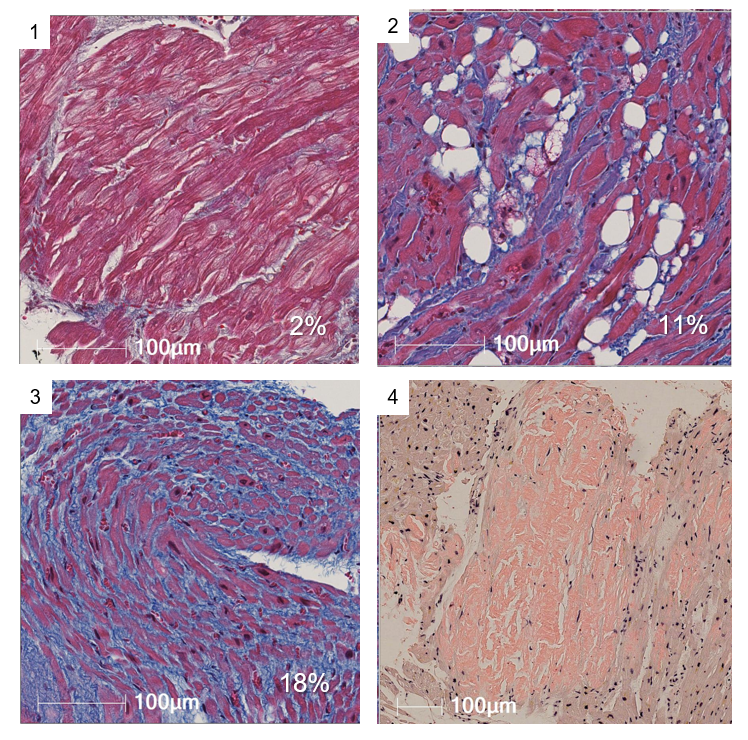
その中心が、心房細動の基質となる心房筋の病理学的評価です。従来、壁の薄い心房筋からの生検は不可能とされてきました。しかし、2020年6月以降、当グループは、研究にご協力いただいたアブレーション患者さんの心房筋から安全に心筋を採取する心房生検方法を確立し、その病理学的評価を開始しました。そして、心房細動患者の心房筋には、様々な程度の炎症や線維化、アミロイド沈着など様々な病理学的変化を認めることがわかってきました。また、これらの病理学的変化のサロゲートとなるバイオマーカーの探索も行なっております。
さらに、東京大学医学部循環器内科、理化学研究所、大分大学循環器内科と共同研究を開始し、全ゲノム解析、オミックス解析、電子顕微鏡による心房筋の微細構造の評価なども行なっております。我々は、個々の患者さんのゲノム 情報、オミックス情報、各種バイオマーカーによる炎症のプロファイリング等に基づく精密医療の実現に向け、全力で研究を進めています。
1.心房筋生検による心房細動基質の組織学的評価/Histological Evaluation of Atrial Fibrillation Substrate Based on Atrial Septum Biopsy(HEAL-AF Study, HEAL-AF Study2)
これまで心房細動における心房筋の組織学的研究は、重症弁膜症に伴う開心術時の生検例、または剖検例のみの検討であり、心房細動の大多数を占める非弁膜症性心房細動例における組織学的評価はほとんどなされていませんでした。そこで、2020年6月より当院主導により、心房細動アブレーション例100例を研究対象とする観察研究である「心房筋生検による心房細動基質の組織学的評価 Histological Evaluation of Atrial Fibrillation Substrate Based on Atrial Septum Biopsy (HEAL-AF Study)」を開始しました。
この研究は世界初の観察研究で、主要な目的は①組織学的所見とアブレーション後の予後の相関、②心房筋生検の安全性、③心房筋および心室筋の組織学的所見の違い、④心房筋の組織学的所見と心房双極電位波高との関連等を評価することです。2020年12月までに100例の心房筋生検が終了し、検体の組織学的評価により線維化の進行・アミロイドの沈着・炎症系細胞の浸潤など、心房心筋症というべき多彩な病理学的変化を確認することでができました。また生検手技に伴う合併症は一切認めず、手技の安全性も確認できました。
そして2021年1月から先行のHEAL-AF研究に引き続き、HEAL-AF Study2を開始致しました。この研究の主要目的は①組織学的所見とアブレーション後の予後の関係を評価する。さらに、②生検検体の組織学的・生化学的評価および術中に得られる電気生理学的評価に基づく心房細動のメカニズムの解明、および③次世代シークエンサーを用いて心房の病理学的変化に伴う遺伝子発現を網羅的に解析することで遺伝子レベルでのメカニズムの解明を目指すものです。
本研究により個々の症例における tailor-made な内科的治療とアブレーション治療、そして予後予測が可能となるとともに、心房細動のメカニズムの解明が期待でき、その臨床的意義は大きいと考えています。
2.遺伝的素因に基づく心房細動アブレーション後の長期的予後と予測因子の評価/Follow-Up study of paTients UndeRgoing cathEter ablation for Atrial Fibrillation: evaluation of long-term outcomes and predictive factors based on genetic predisposition (FUTURE-AF Study)
社会の高齢化とともに心房細動患者が急増し、心不全や脳梗塞などの合併症を引きおこします。心房細動に対する治療として肺静脈隔離術を主とするカテーテルアブレーションによる洞調律維持治療が積極的に行われるようになってきました。およそ80%の症例において洞調律維持が得られますが、約20%の例においてはアブレーションによる洞調律維持が困難です。さらにいったん洞調律が得られていた例においても、長期的な経過観察中に心房細動の再発を認める例が少なくありません。その原因の1つとして遺伝的素因による心筋の電気生理学的特性、心房および心房周囲の構造的特性が考えられます。
2017年に理化学研究所統合生命医科学研究センターの研究チームは、日本人集団の大規模ゲノムワイド関連解析(GWAS)を行い、日本人の心房細動発症に関わる感受性遺伝子上の一塩基多型(SNP)を新たに同定するとともに、既知の SNP と合わせて 15 個の SNP のジェノタイプデータを用いて心房細動発症リスクの遺伝的リスクスコア(genetic risk score) を作成しました。
本研究は、日本人集団における心房細動の遺伝的リスクスコアが心房細動アブレーション術後36ヶ月間における心臓血管イベント発生率、および心房細動再発を予測するかどうかを前向きに評価することおよび、横断的にSNPと臨床的背景・電気生理学的因子の関連を評価すること等を目的としています。
本研究により遺伝的素因と心房細動および心房細動アブレーション後の予後の関連が明らかになるとともに、本研究が心房細動診療におけるゲノム情報の有用性を示し精密医療の実現に貢献する可能性があり、その臨床的意義は大きいと考えています。
3.心房細動アブレーション患者におけるGrid型電極を用いた左房双極電位波高マッピングに関する後ろ向き研究
心房細動アブレーション治療の根幹は、肺静脈の電気的隔離術です。持続性心房細動では、肺静脈隔離以外に追加的アブレーションが必要とされます。その1つが、左房内双極電位波高に基づく治療戦略です。左房内の線維化を示唆する低電位領域がなければ肺静脈隔離術単独での治療成績が良好であり、一方、左房内に低電位領域があれば肺静脈隔離術単独の治療成績が不良であることがわかっています[1-4]。この低電位領域は、追加的アブレーションの治療対象となることも報告されています[2-4]。
しかし、双極電位波高値は、マッピング電極の電極長・電極間距離・電極配置、そして、興奮伝播の方向とペア電極の位置関係により、その値が大きく変化し、双極電位波高マッピングの正確性には限界があります[5]。また低電位領域の定義は、これまで双極電位波高値<0.5mVとされることが多かったのですが、双極電位波高マッピングの欠点のために、その定義については結論が出ていません。
2018年9月より、新しいGrid型デザインのマッピング電極(AdvisorTM HD Grid Mapping Catheter, Sensor EnabledTM, Abbott)が臨床的に使用可能となりました。本電極の使用により、従来のリング状電極で出現していた低電位領域の面積が明らかに減少するとともに、明瞭な伝導遅延や伝導ブロック部位が描出されることがわかっています[6]。
当院でも2018年10月1日から2019年3月31日の期間に心房細動アブレーションを施行した患者さんを対象にGrid型電極を用いたマッピングを施行し、その解析により低電位領域の存在とその範囲は、心房全体の双極電位波高の低下と強く相関することを証明しました。[7,8] つまり、低電位領域だけが電位が低いのではなく、低電位領域の存在は心房全体の電位の低下の反映であること、そして心房の病理学的変化は心房全体に生じていることが強く示唆されました。
<参考文献>
- Yamaguchi T, Tsuchiya T, Nagamoto Y, Miyamoto K, Murotani K, Okishige K, Takahashi N. Long-term results of pulmonary vein antrum isolation in patients with atrial fibrillation: an analysis in regards to substrates and pulmonary vein reconnections. Europace. 2014; 16: 511-520.
- Yamaguchi T, Tsuchiya T, Nakahara S, Fukui A, Nagamoto Y, Murotani K, Eshima K, Takahashi N. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol. 2016; 27: 1055-1063.
- Yamaguchi T, Tsuchiya T, Fukui A, Kawano Y, Otsubo T, Takahashi Y, Hirota K, Murotani K, Eshima K, Takahashi N. Impact of the extent of low-voltage zone on outcomes after voltage-based catheter ablation for persistent atrial fibrillation. J Cardiol. 2018; 72: 427-433.
- Kircher S, Arya A, Altmann D, Rolf S, Bollmann A, Sommer P, Dagres N, Richter S, Breithardt OA, Dinov B, Husser D, Eitel C, Gaspar T, Piorkowski C, Hindricks G. et al. Individually tailored vs. standardized substrate modification during radiofrequency catheter ablation for atrial fibrillation: a randomized study. Europace 2018; 20: 1766-1775.
- Miyamoto K, Tsuchiya T, Narita S, Yamaguchi T, Nagamoto Y, Ando S, Hayashida K, Tanioka Y, Takahashi N. Bipolar electrogram amplitudes in the left atrium are related to local conduction velocity in patients with atrial fibrillation. Europace. 2009;11:1597-605.
- Yamaguchi T, Fukui A, and Node K. Bipolar Voltage Mapping for the Evaluation of Atrial Substrate: Can We Overcome the Challenge of Directionality? J of Atrial Fibrillation. 2018.
- Takanori Yamaguchi, Toyokazu Otsubo, Kana Nakashima, Mai Tahara, Akira Fukui, Kei Hirota, Yuya Takahashi, Takayuki Kitai, Naohiko Takahashi, and Koichi Node. Association between Local Slow Conduction and Bipolar Voltage – an Analysis Using HD Grid Mapping Catheter in Atrial Fibrillation Patients. 12th Asia Pacific Heart Rhythm Society Scientific Session (APHRS 2019).
- Toyokazu Otsubo, Takanori Yamaguchi, Kana Nakashima, Mai Tahara, Akira Fukui, Kei Hirota, Yuya Takahashi, Takayuki Kitai, Naohiko Takahashi, and Koichi Node. Does Low Voltage Zone Represent Localized Fibrosis? –an Analysis Using HD Grid Mapping Catheter in Atrial Fibrillation Patients. 12th Asia Pacific Heart Rhythm Society Scientific Session (APHRS 2019).

